摘要:碳化硅(SiC)作为工业领域应用广泛的一种重要非氧化物材料,可以采用甲烷(CH4)气体,利用氧化硅的碳热还原工艺来制备。本研究利用反作用力场(ReaxFF)分子动力学(MD)技术,采用SiO和CH4混合气体在不同固态表面如β-SiC、石墨片、铁、无定形SiO2等上面对反应初始阶段进行观察研究。MD结果显示:SiO簇丛的快速形成对反应有重要影响。较高的SiO温度增强了SiC表面单个SiC分子的形成。石墨片表面虽然也能形成SiC分子,但目前尚未发现模拟时间段内在铁和SiO2的表面有反应发生。
关键词:碳化硅, 甲烷, 反应机理
1、引言
金属氧化物的热碳还原是金属加工工艺中的传统方法,通过和还原剂(碳)的反应,该工艺可以将金属氧化物中的氧去除掉,从而得到金属的基本形式。还原工艺所用碳源通常为煤或焦炭,近年来甲烷逐渐替代煤和焦炭,具有碳素活度更好,还原温度较低,能耗低、CO2排放少的优势。
氧化还原工艺需要高温的条件,但在高温下会发生甲烷分解反应,生成C和H2,进而生成固态碳,和炭黑类似。为防止甲烷高温分解,SINTEF(挪威理工大学)研究出一种特殊技术,通过SiO热气体和固态碳发生反应生成SiC。实验还设计了一种特殊水冷却喷枪,可以实现SiO热气体和甲烷冷气体接触反应以防止甲烷高温分解成碳和氢气。
但Si-C-H-O系统中的一些反应尚未得到明确辨认。Kai等人利用反作用力场分子动力学模拟在1600℃温度中在β-SiC固态表面上进行SiO和CH4气态混合物的反应;反应机理研究结果表明,SiO冷凝并聚合成环状结构对反应机理有重要影响;而甲烷则分解为CH3、CH2或CH。CH3和SiO分解出的单个硅原子结合,最终生成SiC。实验还研究了温度影响因素(1200℃和1600℃)。采用不同固态表面如石墨片、铁、无定形SiO2来分析对SiC形成的影响。
2、ADF/REAXFF模拟
ReaxFF由Duin及其同事创建,根据反作用力场方法可以进行化学反应建模,目前已纳入SCM/ADF,可以进行类比和大规模MD模拟。
2.1 温度对β-SiC表面上SiC生成的影响
利用SiC分子力场对SiO和CH4的气态混合物反应动力学进行建模。在原子模型中,如图1a所示,200个SiO分子和300个CH4分子随机分散在92×92×200Å尺寸的盒子中。气态混合物密度为0.009g/ml。盒子中间嵌入一个带有五晶格厚度的单晶β-SiC的超晶胞。CH4气体温度设定为20℃,SiO气体温度设定为1200℃和1600℃。固定好SiC层的空间位置。MD模拟利用了Verlet和Berendsen算法速度。时间步和阻尼常数分别为0.25和500fs。
0.3ns后,每个气态分子都被吸附到SiC层上,如图1b所示。反应物分子数量随时间延长而降低,如图2所示。但SiO比CH4的消耗更快,在1.5ns后耗尽。高温增强了CH4的分解率。值得注意的是,在0.08ns内,不同温度对SiO还原的影响不是太大,但在0.08ns后1600℃曲线出现了陡然下降;该原因尚不明确,有待进一步研究。

图2:1200℃和1600℃条件下CH4分子和SiO分子数目的降低
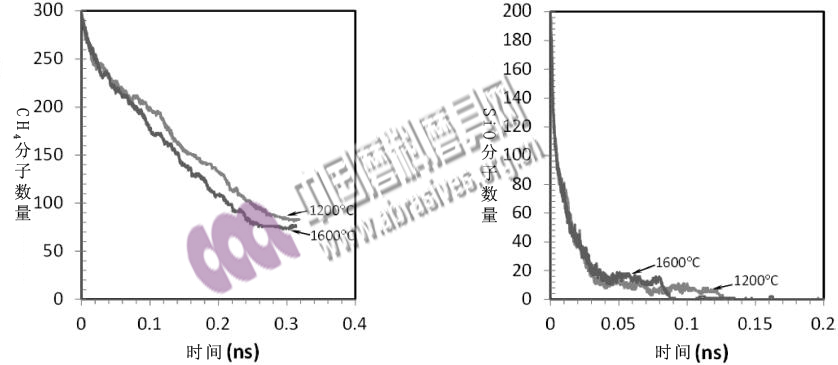
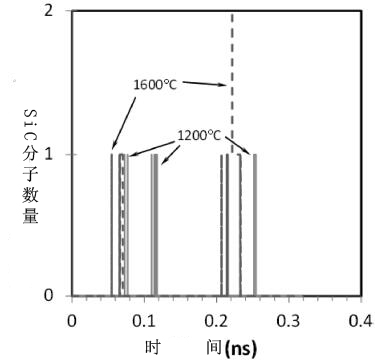
图4:1200℃下生成的SiC快拍照

图5a为100个SiO分子、150个CH4分子和晶格大小为5×4、4×4、3×3的3、4、5个双层石墨片构成的建模系统。所有分子最初都随机分散在边长为100Å的立方体盒子中;CH4气体温度设定为20℃,系统的其他区域温度设定为1600℃。其他参数设置和2.1部分相同。
0.32ns后,石墨片高度扭曲变形,但大部分反应分子都依附在上面,如图5b所示。只有1个SiC分子是在0.311ns后形成的。这可能是由于CH和SiO直接反应的缘故(如图6所示)。
2.3 Fe和SiO2表面上SiO和CH4的反应
如图7a、8a所示,在Fe和SiO2表面上进行反应的两个原子模型中,有200个SiO2分子和300个CH4分子随机分散在92×92×200Å的立方体盒子中。盒子中间嵌入了一个带有五晶格厚度α-铁单晶或单个SiO2结构的超晶胞。

图6:SiC形成过程快拍照

图7:铁表面上CH4+SiO反应系统在1400℃下的初始结构(a)和最终结构(b)

图8:SiO2表面上CH4+SiO反应系统在1600℃下的初始结构(a)和最终结构(b)

在较长一段时间(0.5ns)之后,尽管大部分气态分子都依附在了固态表面,但没有SiC生成,如图7b和8b所示。
3、结论
本研究利用反作用力场(ReaxFF)分子动力学(MD)技术,采用SiO和CH4混合气体在不同固态表面如β-SiC、石墨片、铁、无定形SiO2等上面对SiC形成机理进行研究。实验结果显示,SiO簇丛的快速形成对反应有着重要影响。SiO气体的高温增强了SiC表面上单个SiC分子的形成。石墨片表面虽然也能形成SiC分子,但目前尚未发现模拟时间段内在铁和SiO2的表面有反应发生。
Methane, Chem. Eng. Technol 30(8): 1123–1128.
2. Jamshidi, E. & Ebrahim, H.A. 2008. A new clean process for barium carbonate preparation by barite reduction with methane, Chem Eng Process 47(9): 567–1577.
3. Khoshandam, B., Kumar, R.V. & Jamshidi, E. 2006. Producing Chromium Carbide Using Reduction of Chromium Oxide with Methane, AIChE Journal 52(3): 1094–1102.
4. Monsen, B., Kolbeinsen, L., Prytz, S., Myrvågnes, V. & Tang, K. 2013. Possible Use of Natural Gas For Silicon or ferrosilicon Production, in Proceeding of the 13th International Ferroalloys Congress, Kazakhstan, Vol. 1: 467–478.
5. Newsome, D., Sengupta, D., Foroutan, H., Russo, M.F. & van Duin, A.C.T. 2012. Oxidation of Silicon Carbide by O2 and H2O: A ReaxFF Reactive Molecular Dynamics Study: Part I, J. Phys. Chem. C 116(30): 16111–16121.
6. Ostrovski, O. & Zhang, G. 2006. Reduction and Carburization of Metal Oxides by Methane-Containing Gas, AIChE Journal 52(1): 300–310.
7. Ostrovski, O., Zhang, G., Kononov, R., Dewan, M.A.R. & Li, J. 2010. Carbothermal Solid State
Reduction of Stable Metal Oxides, Steel Research Int. 81(10): 841–846.
8. SCM 2014. ReaxFF 2014, Vrije Universiteit, Amsterdam, The Netherlands, http://www.scm.com.
9. Tang, K., Ma, X., Andersson, S. & Dalaker, H. 2015. Kinetics between SiO and CH4 at High Temperature. In Jiang, T. etc. (eds), 6th International Symposium on High-Temperature Metallurgical Processing: 349–356, TMS (The Minerals, Metals & Materials Society). van Duin, A.C.T. 2002. ReaxFF User Manual.


 手机资讯
手机资讯 官方微信
官方微信







 豫公网安备41019702003604号
豫公网安备41019702003604号